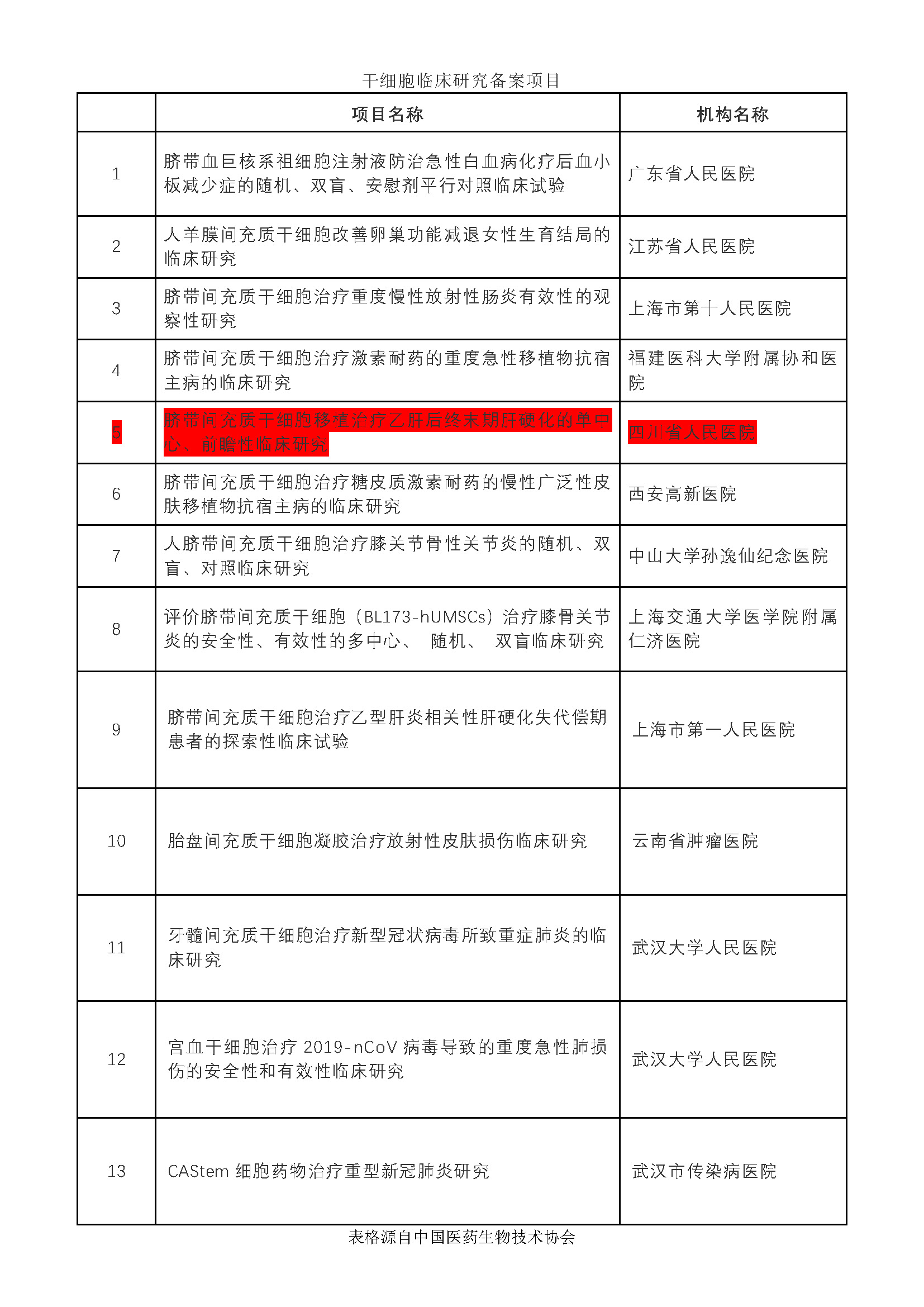
2020年11月,廣東省人民醫(yī)院等十二家醫(yī)療機構的13個幹細胞臨床研究項目按照《幹細胞臨床研究管理(lǐ)辦法(試行)》(國衛科教發〔2015〕48号)的規定完成備案。
至此,幹細胞臨床研究備案機構增至111家,備案項目達100個。
其中亞洲幹細胞™集團旗下(xià)上(shàng)海泉生™生物科技有限公司(以下(xià)簡稱“泉生生物”)聯合四川省人民醫(yī)院開(kāi)展的幹細胞臨床研究項目“臍帶間充質幹細胞移植治療乙肝後終末期肝硬化的單中心、前瞻性臨床研究”成功獲得項目與機構“雙備案”。

亞洲幹細胞™始終以“讓每個人都有機會(huì)掌握對(duì)生命的話(huà)語權”爲使命,踐行着關懷生命,以前沿的幹細胞醫(yī)療爲現(xiàn)有醫(yī)療手段無法根治的疾病提供新策略。
此次泉生生物與四川省人民醫(yī)院的幹細胞臨床研究項目成功備案更加标志着幹細胞醫(yī)療對(duì)于肝硬化疾病的積極作(zuò)用(yòng),同時(shí)也(yě)肯定了(le)我司在幹細胞科研的專業水(shuǐ)準。
一、幹細胞與肝硬化
肝硬化(hepaticcirrhosis)是由一種或多種原因引起的、以肝組織彌漫性纖維化、假小(xiǎo)葉和(hé)再生結節爲組織學特征的進行性慢性肝病。肝硬化通常起病隐匿,病程發展緩慢,臨床上(shàng)将肝硬化大(dà)緻分爲肝功能(néng)代償期和(hé)失代償期。
肝病在中國是一個嚴重的公共衛生問題。據估計(jì),在中國,各類肝病患者約4億人,其中慢性乙型肝炎病毒(HBV)感染者8600萬例,占23.5%;慢性丙型肝炎病毒(HCV)感染者1000萬例,占2.5%;酒精性肝病6000萬例,占15.0%;非酒精性脂肪性肝病2億例,占50.0%,其他(tā)肝病3700萬例,占3.9%。
持續性的慢性肝損傷引起的肝細胞彌漫性變性壞死,繼而出現(xiàn)不可逆轉的纖維瘢痕形成和(hé)肝細胞結節狀再生,故而肝硬化的基本病理(lǐ)改變是以假小(xiǎo)葉形成爲特征。
幹細胞是一類具有多向分化能(néng)力的細胞,可遷移至損傷部位,分化成肝細胞,同時(shí)具有以下(xià)功能(néng):
1. 免疫抑制功能(néng),抑制固有免疫系統應答(dá)和(hé)适應性免疫應答(dá);
2. 分泌營養因子功能(néng)以及幹細胞可直接抑制肝星狀細胞活性等。
爲衆多備受肝硬化折磨的患者帶來(lái)了(le)康複的希望。
二、幹細胞質量
幹細胞臨床研究項目的成功備案離不開(kāi)高(gāo)質量的幹細胞基礎。
從(cóng)2017年底開(kāi)始,國家CDE開(kāi)始受理(lǐ)幹細胞産品以藥品準入藥物臨床試驗(IND),幹細胞質量的檢測方法和(hé)檢測标準受到(dào)業界的廣泛重視(shì),結合傳統GMP規範、幹細胞技術的新理(lǐ)念和(hé)生物制劑的特殊性,形成新的質量趨勢,研究機構和(hé)從(cóng)業公司一時(shí)缺乏質量參考和(hé)标榜,中檢院迅速建立起各檢項和(hé)評價标準,并牽頭和(hé)參與多個指導文(wén)件的出台,讓這(zhè)一新興産業,規範了(le)質量标準。
泉生生物嚴格遵循《幹細胞臨床研究管理(lǐ)辦法》、《體細胞治療臨床研究和(hé)轉化應用(yòng)管理(lǐ)辦法(試行)征求意見稿》和(hé)《細胞治療産品研究與評價技術指導原則》等一些(xiē)列政策法規。積極參與幹細胞技術與産品的臨床轉化工(gōng)作(zuò),投身幹細胞臨床研究項目。
目前法規規定,人用(yòng)幹細胞項目使用(yòng)的幹細胞産品應取得第三方檢測機構出具的質量檢測報(bào)告,中檢院是國家檢驗藥品生物制品質量的法定權威機構
泉生生物通過中檢院複核檢定,獲得以下(xià)中檢院《檢驗報(bào)告》:(SH202003392)、(SH202003393)、(SH202003394)



三、項目合作(zuò)方簡介
此次備案項目研究機構四川省人民醫(yī)院擁有6個國家臨床重點專科(檢驗科、臨床護理(lǐ)、腎髒科、急診醫(yī)學科、重症醫(yī)學科、臨床藥學),4個四川省重點實驗室(人類疾病基因研究、超聲醫(yī)學、臨床免疫轉化醫(yī)學、個體化藥物治療),4個四川省臨床醫(yī)學研究中心,3個國家中醫(yī)藥管理(lǐ)局二級實驗室,34個省醫(yī)學重點學科。近年來(lái),獲廳局級以上(shàng)科研項目1500餘項,其中國家重點研發計(jì)劃2項。獲授權專利500餘項,專利實施轉化57項。獲國家科技進步獎、四川省科技進步獎共計(jì)72項,構成了(le)強大(dà)的優勢學科集群,爲科研和(hé)新技術開(kāi)發奠定了(le)堅實的基礎。
項目申辦方上(shàng)海泉生生物科技有限公司(簡稱“泉生生物”)坐(zuò)落于上(shàng)海“千人計(jì)劃”創業園。泉生生物嚴格依照國家幹細胞相關法規政策要求,專業從(cóng)事(shì)幹細胞制劑臨床前研究/試驗(藥學研究、藥效學研究及藥理(lǐ)毒理(lǐ)研究等)、人體臨床研究/試驗、IND/NDA注冊申報(bào)及産業化。在上(shàng)海市政府大(dà)力支持下(xià),公司建立了(le)“上(shàng)海千人計(jì)劃創業園區(qū)域細胞制備中心”,擁有800㎡符合GMP标準的臨床級細胞制劑制備車間,是上(shàng)海市細胞治療産業重要基礎平台,目前主要爲醫(yī)療機構、科研機構等提供臨床級、可回溯的細胞制品。
通過此項幹細胞臨床研究,可優化臨床治療方案,積累幹細胞治療肝硬化數據,驗證幹細胞在抗炎、免疫調節和(hé)組織損傷修複方面的作(zuò)用(yòng),以加快(kuài)間充質幹細胞臨床應用(yòng)進程。
人類已經來(lái)到(dào)了(le)“細胞治療”時(shí)代,我們用(yòng)“幹細胞”來(lái)治病、美(měi)容、抗衰老(lǎo)、管理(lǐ)健康。在疾病治療方面,細胞治療已經爲包括腫瘤在内的百餘種疾病提供新的治療方案,被認爲繼手術、化療、放(fàng)療、靶向藥物後新的具有前景的治療方法,也(yě)是目前全球科研和(hé)臨床研究的重點領域。
在不遠的将來(lái),希望通過各方共同攜手努力,促進我國幹細胞治療技術和(hé)新藥研發更好(hǎo)更快(kuài)地發展!讓更多患者群體受益!


